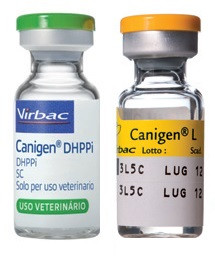
Каниген DHPPi/L – Virbac
Вакцина Каниген DHA2PPi/L (Canigen DHA2PPi/L) для профілактики чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак, що викликається лептоспірами серогруп Canicola та Icterohaemorragiae. 1 доза – 2 флакони (сухий + рідкий компонент). Лікарська форма: сухий компонент (Каниген DHA2PPi) – для ліофілізат для приготування суспензії для инъекций (жива вакцина) і рідкий компонент (Каниген L) – суспензія для инъекций (інактивована вакцина). Загальні відомості Сухий компонент (Каниген DHA2PPi) виготовлений з аттенуйованих штамів вірусу чумі м ясоїдних (штамів Lederle VR 128), аденовірусу типу 2 (CAV-2 штамів Manhattan), парвовіруса собак типу CPV Cornell (штамів CPV 780916), вірусу парагрипу собак (CPIV штамів Manhattan), з додаванням допоміжних речовин: лактози моногідрат – 126 мг/доза, калію дигідрофосфат – 0,64 мг/доза. Рідкий компонент (Каниген L) виготовлений з інактивованих тиомерсалом культур лептоспір серогруп Canicola та Icterohaemorragiae з додаванням допоміжних речовин: калію дигідрофосфат – 0,47 мг/доза, вода для инъекций до 1 мл/доза. Сухий компонент (Каниген DHA2PPi) за зовнішнім поглядом представляє собою однорідну суху пористу масу кремового кольору, рідкий компонент (Каниген L) – суспензію від кремового до світло-жовтого кольору. Каниген DHA2PPi розфасований по 1 см3 (1 імунізуюча доза для собак), Каниген L по 1 мл (1 імунізуюча доза для собак) у скляні флакони відповідної місткості, герметично закриті гумовими пробками, укріпленими алюмінієвими ковпачками і закриті пластиковими пломбами. Флакони з сухим (Каниген DHA2PPi) і рідким (Каниген L) компонентами упаковані в пластикові коробки по 10 флаконів шкірного компонента. У кожну коробку з вакциною вкладають інструкцію з її застосування. Термін придатності вакцини 24 місяці з дати виготовлення при дотриманні умов зберігання і транспортування. Після закінчення терміну придатності вакцина не придатна до застосування. Вакцину зберігають і транспортують в закритій упаковці виробника, в сухому, захищеному від світла та недоступному для сторонніх осіб місці, окремо від продуктів харчування та кормів, за температури від 2°С до 8°С. Не допускається заморожування вакцини. Вакцину зберігають у місцях, недоступних для дітей. Флакони з вакциною без етикеток, з порушенням цілісності і герметичності, які зазнали заморожування, із зміненим кольором, з консистенцією, що містять сторонні домішки, після закінчення терміну придатності, а також не використані протягом 2 годин після розчинення, підлягають вибракуванню і знезараженню кип’ятінням протягом 15 хвилин. Утилізація знезараженої вакцини не вимагає спеціальних запобіжних заходів. Біологічні властивості Вакцина Каниген DHA2PPi/L викликає формування імунної відповіді у собак до збудників чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту і лептоспірозу, що викликається лептоспірами серогруп Canicola та Icterohaemorragiae через 21 добу після повторного введення (ревакцинації), тривалістю не менше 12 місяців. Одна імунізуюча доза вакцини містить не менше: вірусу чумі м ясоїдних 103,0 – 105,0 ТЦД50 , аденовірусу м ясоїдних типу 2 104,0 – 106,0 ТЦД50, парвовіруса собак типу CPV Cornell 105,0 – 107,0 ТЦД50, вірусу парагрипу м ясоїдних 105,0 – 107,0 ТЦД50, інактивованого вірусу сказу не менше 1 ME, інактивованих культур лептоспір серогруп Canicola та Icterohaemorragiae – не менше 833 х 106 мікробних клітин/мл кожної. Вакцина нешкідлива, лікувальними властивостями не володіє. Порядок застосування Вакцина призначений для профілактики чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак, що викликається лептоспирами серогруп Canicola та Icterohaemorragiae. Заборонено прищеплювати клінічно хворих і/або ослабленого тварин. Протипоказано застосовувати собакам в період вагітності і лактації. За 10 днів до вакцинації необхідно провести дегельмінтизацію собаки. Вакцинації підлягають цуценята, починаючи з 8-тижневого віку. Вакцину вводять підшкірно в об ємі 1 мл (1 імунізуюча доза на одне введення, незалежно від маси і породи). Перед застосуванням у флакон з сухим компонентом (Каниген DHA2PPi) за допомогою стерильною шприца вносять рідкий компонент (Каниген L) і ретельно перемішують до повного розчинення сухого компонента. Всі маніпуляції проводять з дотриманням правил асептики. Ефективність імунізації може бути знижена у разі вакцинації тварин, які зазнали впливу стресу. Симптомів прояву чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак або інших патологічних ознак при передозуванні вакцини не встановлено. У рідкісних випадках вакцина може викликати алергійну реакцію. У цьому разі використання препарату припиняють і проводять симптоматичне лікування. Слід унікати порушень схеми проведення вакцинації, оскільки це може призвести до зниження ефективності імунопрофілактики чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак. У разі пропуску чергового введення вакцини необхідно провести імунізацію як можна швидше. При застосуванні вакцини згідно з інструкцією побічних явищ та ускладнень, як правило, не відзначається. У виняткових випадках можлива анафілактична реакція, в цьому випадку проводять симптоматичне лікування. Забороняється застосовувати вакцину Каниген DHA2PPi/L спільно з іншими імунобіологічними лікарськими засобами, а також противірусними препаратами та кортикостероїдами. Застосування препаратів цих груп дозволяється не раніше ніж через 14 діб після введення вакцини Каниген DHA2PPi/L. Терміни можливого використання продукції тваринного походження після введення вакцини Каниген DHA2PPi/L не встановлюються. Заходи особистої профілактики При роботі з вакциною Каниген DHA2PPi/L слід дотримуватися загальні правила особистої гігієни і техніки безпеки, передбачені при роботі з лікарськими засобами. Всі особини, які беруть участь у проведенні вакцинації, повинні бути в спецодязі і забезпечені індивідуальними засобами захисту. Людям з гіперчутливістю до компонентів препарату слід унікати прямого контакту з вакциною Каниген DHA2PPi/L. У місцях роботи повинна бути аптечка першої долікарської допомоги. При попаданні вакцини на шкіру та/або слизові оболонки, їх необхідно змити великою кількістю чистої води. У разі розливу вакцини забруднені поверхні підлягають обробці 2% розчином лугу або 5% розчином хлораміну. При випадковому введенні препарату людині, місце ін’єкції необхідно негайно обробити 70% розчином етилового спирту, звернути в медичну установу і повідомити про це лікаря.
Джерело: https://www.zooapteka.kiev.ua/ua/virbac-canigen-dha2ppil-vkacina
© Зоомагазин Рудий Кіт
Вакцина Каниген DHA2PPi/L (Canigen DHA2PPi/L) для профілактики чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак, що викликається лептоспірами серогруп Canicola та Icterohaemorragiae. 1 доза – 2 флакони (сухий + рідкий компонент). Лікарська форма: сухий компонент (Каниген DHA2PPi) – для ліофілізат для приготування суспензії для инъекций (жива вакцина) і рідкий компонент (Каниген L) – суспензія для инъекций (інактивована вакцина). Загальні відомості Сухий компонент (Каниген DHA2PPi) виготовлений з аттенуйованих штамів вірусу чумі м ясоїдних (штамів Lederle VR 128), аденовірусу типу 2 (CAV-2 штамів Manhattan), парвовіруса собак типу CPV Cornell (штамів CPV 780916), вірусу парагрипу собак (CPIV штамів Manhattan), з додаванням допоміжних речовин: лактози моногідрат – 126 мг/доза, калію дигідрофосфат – 0,64 мг/доза. Рідкий компонент (Каниген L) виготовлений з інактивованих тиомерсалом культур лептоспір серогруп Canicola та Icterohaemorragiae з додаванням допоміжних речовин: калію дигідрофосфат – 0,47 мг/доза, вода для инъекций до 1 мл/доза. Сухий компонент (Каниген DHA2PPi) за зовнішнім поглядом представляє собою однорідну суху пористу масу кремового кольору, рідкий компонент (Каниген L) – суспензію від кремового до світло-жовтого кольору. Каниген DHA2PPi розфасований по 1 см3 (1 імунізуюча доза для собак), Каниген L по 1 мл (1 імунізуюча доза для собак) у скляні флакони відповідної місткості, герметично закриті гумовими пробками, укріпленими алюмінієвими ковпачками і закриті пластиковими пломбами. Флакони з сухим (Каниген DHA2PPi) і рідким (Каниген L) компонентами упаковані в пластикові коробки по 10 флаконів шкірного компонента. У кожну коробку з вакциною вкладають інструкцію з її застосування. Термін придатності вакцини 24 місяці з дати виготовлення при дотриманні умов зберігання і транспортування. Після закінчення терміну придатності вакцина не придатна до застосування. Вакцину зберігають і транспортують в закритій упаковці виробника, в сухому, захищеному від світла та недоступному для сторонніх осіб місці, окремо від продуктів харчування та кормів, за температури від 2°С до 8°С. Не допускається заморожування вакцини. Вакцину зберігають у місцях, недоступних для дітей. Флакони з вакциною без етикеток, з порушенням цілісності і герметичності, які зазнали заморожування, із зміненим кольором, з консистенцією, що містять сторонні домішки, після закінчення терміну придатності, а також не використані протягом 2 годин після розчинення, підлягають вибракуванню і знезараженню кип’ятінням протягом 15 хвилин. Утилізація знезараженої вакцини не вимагає спеціальних запобіжних заходів. Біологічні властивості Вакцина Каниген DHA2PPi/L викликає формування імунної відповіді у собак до збудників чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту і лептоспірозу, що викликається лептоспірами серогруп Canicola та Icterohaemorragiae через 21 добу після повторного введення (ревакцинації), тривалістю не менше 12 місяців. Одна імунізуюча доза вакцини містить не менше: вірусу чумі м ясоїдних 103,0 – 105,0 ТЦД50 , аденовірусу м ясоїдних типу 2 104,0 – 106,0 ТЦД50, парвовіруса собак типу CPV Cornell 105,0 – 107,0 ТЦД50, вірусу парагрипу м ясоїдних 105,0 – 107,0 ТЦД50, інактивованого вірусу сказу не менше 1 ME, інактивованих культур лептоспір серогруп Canicola та Icterohaemorragiae – не менше 833 х 106 мікробних клітин/мл кожної. Вакцина нешкідлива, лікувальними властивостями не володіє. Порядок застосування Вакцина призначений для профілактики чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак, що викликається лептоспирами серогруп Canicola та Icterohaemorragiae. Заборонено прищеплювати клінічно хворих і/або ослабленого тварин. Протипоказано застосовувати собакам в період вагітності і лактації. За 10 днів до вакцинації необхідно провести дегельмінтизацію собаки. Вакцинації підлягають цуценята, починаючи з 8-тижневого віку. Вакцину вводять підшкірно в об ємі 1 мл (1 імунізуюча доза на одне введення, незалежно від маси і породи). Перед застосуванням у флакон з сухим компонентом (Каниген DHA2PPi) за допомогою стерильною шприца вносять рідкий компонент (Каниген L) і ретельно перемішують до повного розчинення сухого компонента. Всі маніпуляції проводять з дотриманням правил асептики. Ефективність імунізації може бути знижена у разі вакцинації тварин, які зазнали впливу стресу. Симптомів прояву чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак або інших патологічних ознак при передозуванні вакцини не встановлено. У рідкісних випадках вакцина може викликати алергійну реакцію. У цьому разі використання препарату припиняють і проводять симптоматичне лікування. Слід унікати порушень схеми проведення вакцинації, оскільки це може призвести до зниження ефективності імунопрофілактики чумі, інфекційного гепатиту, аденовірусної інфекції, парагрипу, парвовірусного ентериту та лептоспірозу собак. У разі пропуску чергового введення вакцини необхідно провести імунізацію як можна швидше. При застосуванні вакцини згідно з інструкцією побічних явищ та ускладнень, як правило, не відзначається. У виняткових випадках можлива анафілактична реакція, в цьому випадку проводять симптоматичне лікування. Забороняється застосовувати вакцину Каниген DHA2PPi/L спільно з іншими імунобіологічними лікарськими засобами, а також противірусними препаратами та кортикостероїдами. Застосування препаратів цих груп дозволяється не раніше ніж через 14 діб після введення вакцини Каниген DHA2PPi/L. Терміни можливого використання продукції тваринного походження після введення вакцини Каниген DHA2PPi/L не встановлюються. Заходи особистої профілактики При роботі з вакциною Каниген DHA2PPi/L слід дотримуватися загальні правила особистої гігієни і техніки безпеки, передбачені при роботі з лікарськими засобами. Всі особини, які беруть участь у проведенні вакцинації, повинні бути в спецодязі і забезпечені індивідуальними засобами захисту. Людям з гіперчутливістю до компонентів препарату слід унікати прямого контакту з вакциною Каниген DHA2PPi/L. У місцях роботи повинна бути аптечка першої долікарської допомоги. При попаданні вакцини на шкіру та/або слизові оболонки, їх необхідно змити великою кількістю чистої води. У разі розливу вакцини забруднені поверхні підлягають обробці 2% розчином лугу або 5% розчином хлораміну. При випадковому введенні препарату людині, місце ін’єкції необхідно негайно обробити 70% розчином етилового спирту, звернути в медичну установу і повідомити про це лікаря.
Джерело: https://www.zooapteka.kiev.ua/ua/virbac-canigen-dha2ppil-vkacina
© Зоомагазин Рудий Кіт
Вакцина Каниген DHA2PPi/L вызывает формирование иммунного ответа у собак к возбудителям чумы, инфекционного гепатита, аденовирусной инфекции, парагриппа, парвовирусного энтерита и лептоспироза, вызываемого лептоспирами серогрупп Canicola и Icterohaemorragiae через 21 сутки после повторного введения (ревакцинации), продолжительностью не менее 12 месяцев.
Одна иммунизирующая доза вакцини містить не менше: вірусу чуми м’ясоїдних 103,0 – 105,0 ТЦД50 , аденовірусу м’ясоїдних типу 2 104,0 – 106,0 ТЦД50, парвовируса собак типу CPV Cornell 105,0 – 107,0 ТЦД50, вірусу парагрипу м’ясоїдних 105,0 – 107,0 ТЦД50, інактивованого вірусу сказу не менше 1 ME, інактивованих культур лептоспір серогруп Canicola та Icterohaemorragiae – не менше 833 х 106мікробних клітин/мл кожної.
Вакцина нешкідлива, лікувальними властивостями не володіє.
Лише авторизовані клієнти, які придбали цей товар, можуть залишити відгук.














Відгуки
Ще немає відгуків.